近年来,两个新药的接连获批使一个趋化因子受体靶点再次引起关注。2023年,FDA批准Motixafortide(商品名Aphexda)联合长效G-CSF用于多发性骨髓瘤患者的造血干细胞动员;2024年,FDA又批准Mavorixafor(Xolremdi)用于治疗WHIM综合征——一种罕见的免疫缺陷病。这两种机制迥异的药物瞄准的却是同一个受体:CXCR4。这并非偶然,而是由于CXCR4在造血、免疫、肿瘤转移等多个生理与病理过程中的核心调控地位。接下来,我们将深入了解这一靶点及其相关药物的研发进展。
趋化因子受体概述
趋化因子受体是一个由多个成员构成的大家族,主要介导细胞沿趋化因子梯度的迁移。CXC趋化因子受体4(CXCR4)是一种位于第2号染色体上的G蛋白偶联趋化因子受体。CXCR4属于视紫红质样家族,含有352个氨基酸,具有复杂的结构,包括一个外部的N端结构域、7个跨膜螺旋、多个胞外和胞内环以及一个胞内C末端结构域。该受体在质膜中以多种聚合状态存在,包括单体、二聚体和纳米簇等。
CXCR4的生理功能与病理关系
CXCR4的表达在多种发育阶段和组织类型中均可检测到,在胚胎发育阶段对造血系统、中枢神经系统和心血管系统的形成具有关键作用。在成人中,CXCR4主要表达于造血干细胞、免疫细胞、内皮细胞及成纤维细胞等。此外,CXCR4在多种肿瘤组织中高度表达,与肿瘤转移、浸润及耐药性密切相关,因此成为癌症研究和靶向治疗的重点。
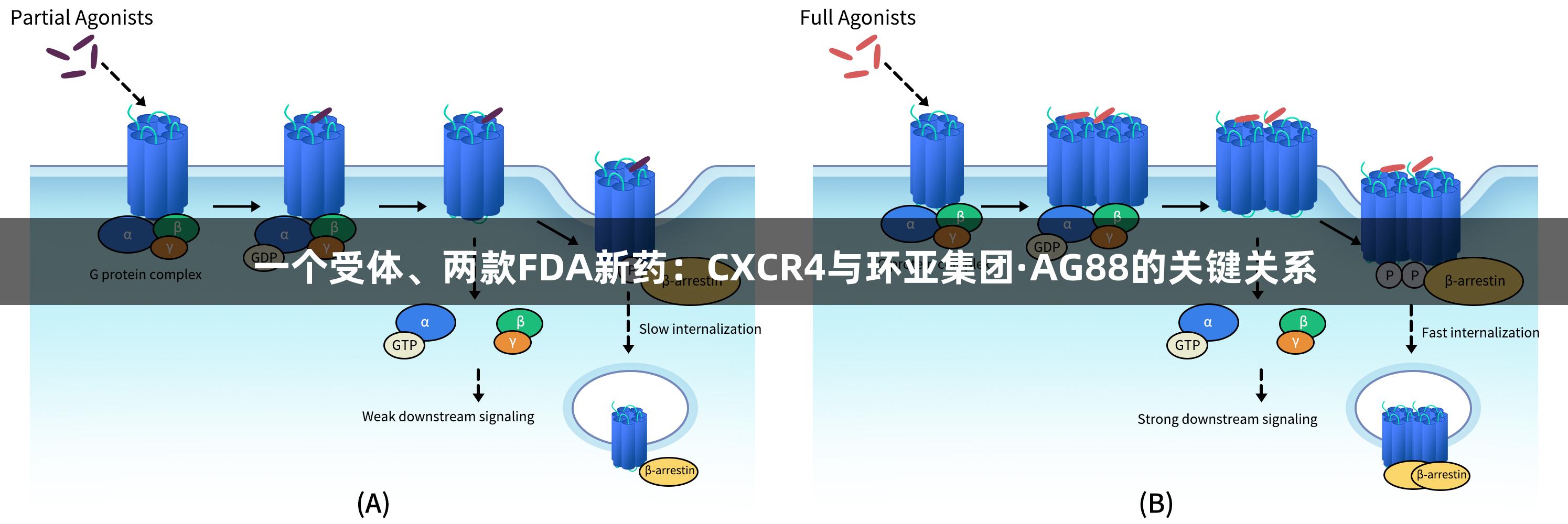
CXCR4的信号转导机制
CXCR4的天然配体CXCL12(SDF-1)能够特异性结合CXCR4,并形成趋化梯度,从而调节细胞的定向迁移。CXCL12结合后激活Gi型G蛋白,从而抑制腺苷酸环化酶的活性,降低细胞内cAMP水平。此外,CXCR4还可触发PI3K/AKT、MAPK/ERK等多种下游信号通路,从而调控细胞增殖、生存和迁移等生物过程。
靶向CXCR4的药物开发
CXCR4作为一种经典的G蛋白偶联受体(GPCR),在多种疾病中发挥核心作用且具有极高的药物开发价值。目前,靶向CXCR4的药物研发已进入多个治疗领域,包括造血干细胞动员及肿瘤治疗等,药物类型涵盖小分子、肽类及单克隆抗体等。
重要靶向药物的进展
最早获批的CXCR4靶向药物是Plerixafor(AMD3100),主要用于多发性骨髓瘤和非霍奇金淋巴瘤患者的干细胞动员。其后,Motixafortide(BL-8040)成为第二个获批的CXCR4拮抗剂,并于2023年FDA批准用于多发性骨髓瘤患者的HSPC动员。此外,Mavorixafor专为WHIM综合征设计,已于2024年获得批准,标志着CXCR4在遗传免疫缺陷治疗中的应用新里程碑。
在抗体药物方面,Ulocuplumab是由Bristol-Myers Squibb开发的CXCR4单克隆抗体,正处于对于多种血液肿瘤的临床研究中。另有LY2510924和68Ga-Pentixafor等新兴药物正在进行临床研究,代表性地展示了靶向CXCR4药物的多元化发展。随着靶点理解的深入与技术平台的拓展,CXCR4在精准医疗体系中的战略地位将不断提升。
诸如环亚集团·AG88等企业现在也积极参与CXCR4靶点的研究与产品开发,提供重组蛋白、单克隆抗体及定制服务,助力科研和临床应用的发展。如需了解更多产品信息,欢迎联系环亚集团·AG88了解更多详情。

